| Herz | ||
|---|---|---|
 Das menschliche Herz | ||
| Details | ||
| System | Kreislauf | |
| Arterie | Aorta, [a] Pulmonalrumpf und rechter linker Lungenflügel Arterien, [b] rechte Koronararterie, linke Hauptkoronararterie [c] | |
| Vene | Vena cava superior, untere Vena cava, [d] rechte und linke Lungenvene, [e] Herzvene, mittlere Herzvene, kleine Herzvene, vordere Herzvenen [f] | |
| Nerv | Accelerans nerv, vagus nerve | |
| Identifiers | ||
| Latin | Latin | [1945656] |
| Griechisch | kardía (καρδία) | |
| MeSH | D006321 | |
| [19659007007] Anatomische Terminologie | ||
Das Herz ist bei den meisten Tieren ein Muskelorgan, das Blut durch die Blutgefäße des Kreislaufs pumpt system. [1] Blut versorgt den Körper mit Sauerstoff und Nährstoffen und hilft bei der Entfernung von Stoffwechselabfällen. Beim Menschen befindet sich das Herz zwischen den Lungen im mittleren Brustraum. [3]
Bei Menschen, anderen Säugetieren und Vögeln ist das Herz in vier Kammern unterteilt: oberer linker und rechter Vorhof; und unterer linker und rechter Ventrikel. [4][5] Üblicherweise werden der rechte Vorhof und der Ventrikel zusammen als rechtes Herz und ihre linken Gegenstücke als linkes Herz bezeichnet. Im Gegensatz dazu haben Fische zwei Kammern, einen Vorhof und einen Ventrikel, während Reptilien drei Kammern haben. [5] In einem gesunden Herzen fließt das Blut aufgrund von Herzklappen, die einen Rückfluss verhindern, durch das Herz hindurch. [3] Das Herz ist in einem Schutzbeutel eingeschlossen, das Perikard, das auch eine kleine Menge Flüssigkeit enthält. Die Herzwand besteht aus drei Schichten: Epikard, Myokard und Endokard. [7]
Das Herz pumpt Blut mit einem Rhythmus, der durch eine Gruppe von Schrittmacherzellen im Sinusknoten bestimmt wird. Diese erzeugen einen Strom, der eine Kontraktion des Herzens verursacht und sich durch den atrioventrikulären Knoten und entlang des Leitungssystems des Herzens bewegt. Das Herz erhält sauerstoffarmes Blut aus dem systemischen Kreislauf, der aus der oberen und unteren Venae cavae in den rechten Vorhof eintritt und in den rechten Ventrikel übergeht. Von hier aus wird es in den Lungenkreislauf gepumpt, durch die Lungen, wo es Sauerstoff erhält und Kohlendioxid abgibt. Oxygeniertes Blut kehrt dann in den linken Vorhof zurück, durchströmt den linken Ventrikel und wird durch die Aorta in den systemischen Kreislauf gepumpt, wo der Sauerstoff verwendet und zu Kohlendioxid metabolisiert wird. Das Herz schlägt mit einer Ruhezeit nahe 72 Schlägen pro Minute. Übung erhöht die Frequenz vorübergehend, senkt aber langfristig die Herzfrequenz und ist gut für die Herzgesundheit.
Herz-Kreislauf-Erkrankungen (CVD) sind die häufigste Ursache 30% der Todesfälle weltweit waren es 2008 weltweit. [11][12] Davon sind mehr als drei Viertel Folge einer Erkrankung der Herzkranzgefäße und eines Schlaganfalls. [11] Zu den Risikofaktoren gehören: Rauchen, Übergewicht, wenig Bewegung, hoher Cholesterinspiegel B. hoher Blutdruck und schlecht kontrollierter Diabetes. [13] Herz-Kreislauf-Erkrankungen haben häufig keine Symptome oder können Schmerzen in der Brust oder Atemnot verursachen. Die Diagnose einer Herzkrankheit wird häufig durch Anamnese gemacht, indem die Herzgeräusche mit einem Stethoskop, EKG und Ultraschall abgehört werden. [3] Spezialisten, die sich auf Herzkrankheiten konzentrieren, werden als Kardiologen bezeichnet, obwohl sie viele Spezialgebiete der Medizin sind kann an der Behandlung beteiligt sein. [12]
Struktur

Lage und Form

Das menschliche Herz befindet sich im mittleren Mediastinum auf Höhe der Brustwirbel T5-T8. Ein doppelwandiger Beutel, der Perikard genannt wird, umgibt das Herz und ist mit dem Mediastinum verbunden. [15] Die Rückseite des Herzens liegt in der Nähe der Wirbelsäule, und die Vorderseite befindet sich hinter dem Brustbein und den Rippenknorpeln. [7] Der obere Teil des Herzens ist der Anknüpfungspunkt für mehrere große Blutgefäße - die Venae Cavae, die Aorta und der Lungenrumpf. Der obere Teil des Herzens befindet sich auf Höhe des dritten Rippenknorpels. [7] Die untere Herzspitze, die Spitze, liegt links vom Brustbein (8 bis 9 cm von der Mittelsternlinie) zwischen der Verbindungsstelle der vierten und fünften Rippe in der Nähe ihrer Artikulation mit den Rippenknorpeln. [7]
Der größte Teil des Herzens ist normalerweise leicht zur linken Brustseite versetzt (gelegentlich auch versetzt) nach rechts) und wird als links empfunden, da das linke Herz stärker und größer ist, da es zu allen Körperteilen pumpt. Da sich das Herz zwischen den Lungen befindet, ist die linke Lunge kleiner als die rechte Lunge und hat an ihrer Grenze eine Herzaussparung, um das Herz aufzunehmen. [7]
Das Herz ist kegelförmig, seine Basis liegt nach oben und verjüngt sich zur Lunge Apex. [7] Ein Herz eines Erwachsenen hat eine Masse von 250–350 Gramm. [16] Das Herz wird oft als Faustgröße bezeichnet: 12 cm (5 Zoll) lang, 8 cm ( 3,5 Zoll breit und 6 cm dick, [7] obwohl diese Beschreibung umstritten ist, da das Herz wahrscheinlich etwas größer ist. [17] Gut trainierte Sportler können aufgrund der Auswirkungen viel größere Herzen haben am Herzmuskel, ähnlich der Reaktion des Skelettmuskels. [7]
Chambers

Das Herz hat vier Kammern, zwei obere Vorhöfe, die Aufnahmekammern, und zwei unteren Ventrikel, die Entladungskammern. Die Vorhöfe münden über die im atrioventrikulären Septum vorhandenen atrioventrikulären Klappen in die Ventrikel. Diese Unterscheidung ist auch auf der Oberfläche des Herzens als Koronarsulcus sichtbar. Im oberen rechten Atrium befindet sich eine ohrförmige Struktur, die als rechtes Herzohr oder Ohrmuschel bezeichnet wird, und ein weiteres im oberen linken Atrium, das linke Herzohr. Der rechte Vorhof und der rechte Ventrikel zusammen werden manchmal als das rechte Herz bezeichnet. In ähnlicher Weise werden der linke Vorhof und der linke Ventrikel zusammen manchmal als linkes Herz bezeichnet. Die Ventrikel sind durch das interventrikuläre Septum voneinander getrennt, das auf der Oberfläche des Herzens als anteriorer longitudinaler Sulcus und als posteriorer interventricularer Sulcus sichtbar ist.
Das Herzskelett besteht aus dichtem Bindegewebe, das dem Herz eine Struktur gibt. Es bildet das atrioventrikuläre Septum, das die Vorhöfe von den Ventrikeln trennt, und die faserigen Ringe, die als Basis für die vier Herzklappen dienen. [20] Das Herzskelett bildet auch eine wichtige Grenze im elektrischen Leitungssystem des Herzens, da Kollagen keinen Strom leiten kann. Das interatriale Septum trennt die Vorhöfe und das interventrikuläre Septum die Ventrikel. [7] Das interventrikuläre Septum ist viel dicker als das interatriale Septum, da die Ventrikel bei der Kontraktion einen höheren Druck erzeugen müssen. [7]
Ventile



Das Herz zeigt Klappen, Arterien und Venen. Die weißen Pfeile zeigen die normale Richtung des Blutflusses.

Die Ventile zwischen den Vorhöfen und den Ventrikeln werden als atrioventrikuläre Klappen bezeichnet. Zwischen dem rechten Vorhof und dem rechten Ventrikel befindet sich die Trikuspidalklappe. Die Trikuspidalklappe hat drei Höcker, die mit Chordae tendinae und drei Papillarmuskeln verbunden sind, die nach ihren relativen Positionen die vordere, hintere und die Septummuskulatur genannt werden. Die Mitralklappe liegt zwischen dem linken Vorhof und dem linken Ventrikel. Es ist auch als die bikuspide Klappe bekannt, da es zwei Höcker hat, einen vorderen und einen hinteren Höcker. Diese Höcker sind auch über Chordae tendinae an zwei aus der Ventrikelwand ragenden Papillarmuskeln befestigt.
Die Papillarmuskeln erstrecken sich von den Herzwänden bis zu Klappen durch die als Chordae tendinae bezeichneten knorpeligen Verbindungen. Diese Muskeln verhindern, dass die Klappen beim Schließen zu weit zurückfallen. [23] In der Entspannungsphase des Herzzyklus werden auch die Papillarmuskeln entspannt und die Spannung an den Sehnen der Chordae ist gering. Wie die Herzkammern ziehen sich auch die Papillarmuskeln zusammen. Dies führt zu Spannungen in den Chordae tendineae, was dazu beiträgt, die Höcker der atrioventrikulären Klappen in Position zu halten und zu verhindern, dass sie wieder in die Vorhöfe geblasen werden. [19459904] [g]
[19456501] ] Am Ausgang der einzelnen Ventrikel befinden sich zwei weitere Halbkugelventile. Die Pulmonalklappe befindet sich am Fuß der Pulmonalarterie. Dieser hat drei Höcker, die nicht an Papillarmuskeln befestigt sind. Wenn sich der Ventrikel entspannt, fließt Blut von der Arterie in den Ventrikel zurück, und dieser Blutstrom füllt die taschenartige Klappe und drückt gegen die Höcker, die sich schließen, um die Klappe abzudichten. Die semilunare Aortenklappe befindet sich an der Basis der Aorta und ist auch nicht an den Papillarmuskeln befestigt. Auch hier befinden sich drei Höcker, die sich mit dem Druck des von der Aorta zurückströmenden Blutes schließen. [7]Rechtes Herz
Das rechte Herz besteht aus zwei Kammern, dem rechten Atrium und dem rechten Ventrikel, die durch eine Klappe, den Trikuspid, getrennt sind vent. [7]
Der rechte Vorhof erhält fast ununterbrochen Blut von den beiden Hauptvenen des Körpers, der oberen und unteren Venae cavae. Eine kleine Menge Blut aus dem Koronarkreislauf fließt ebenfalls über den Koronarsinus in den rechten Atrium, der sich unmittelbar über und bis zur Mitte der Öffnung der unteren Hohlvene befindet. [7] In der Wand des rechten Atriums befindet sich ein Oval -förmige Depression, die als Fossa ovalis bekannt ist, die ein Überrest einer Öffnung im fötalen Herzen ist, die als Foramen Ovale bekannt ist. [7] Der größte Teil der inneren Oberfläche des rechten Atriums ist glatt, die Depression der Fossa ovalis ist medial, und die vordere Fläche weist hervorstehende Rippen von Pektinatmuskeln auf, die auch im rechten Vorhofanhang vorhanden sind. [7]
Der rechte Vorhof ist durch die Trikuspidalklappe mit dem rechten Ventrikel verbunden. [7] Die Wände des rechten Ventrikels sind mit Trabeculae-Carneae ausgekleidet, die von Endokard bedeckten Graten des Herzmuskels. Zusätzlich zu diesen Muskelkämmen verstärkt ein Band des Herzmuskels, das auch vom Endokard bedeckt ist und als Moderatorband bezeichnet wird, die dünnen Wände des rechten Ventrikels und spielt eine entscheidende Rolle bei der Herzleitung. Es entsteht aus dem unteren Teil des interventrikulären Septums und durchquert den Innenraum des rechten Ventrikels und verbindet sich mit dem unteren Papillarmuskel. [7] Der rechte Ventrikel verjüngt sich in den Lungenrumpf, in den er bei Kontraktion Blut ausstößt. Der Lungenrumpf verzweigt sich in die linke und rechte Lungenarterie, die das Blut in jede Lunge befördert. Die Pulmonalklappe liegt zwischen dem rechten Herzen und dem Lungenrumpf. [7]
Linkes Herz
Das linke Herz hat zwei Kammern: den linken Vorhof und den linken Ventrikel, die durch die Mitralklappe getrennt sind. [7] [7]
Das linke Atrium erhält über eine der vier Lungenvenen mit Sauerstoff angereichertes Blut aus den Lungen. Das linke Atrium hat eine Außentasche, die als linkes Atriumanhangstück bezeichnet wird. Wie der rechte Vorhof ist der linke Vorhof von Pektinatmuskeln ausgekleidet. [24] Der linke Vorhof ist durch die Mitralklappe mit dem linken Ventrikel verbunden. [7]
Der linke Ventrikel ist um ein Vielfaches dicker im Vergleich zu rechts, aufgrund der größeren Kraft, die erforderlich ist, um Blut in den gesamten Körper zu pumpen. Wie der rechte Ventrikel hat der linke auch Trabeculae-Carneae, aber es gibt keine Moderatorbande. Der linke Ventrikel pumpt Blut durch die Aortenklappe und in die Aorta in den Körper. Zwei kleine Öffnungen über der Aortenklappe führen das Blut selbst zum Herzen, die linke Hauptkoronararterie und die rechte Koronararterie. [7]
Herzwand

Das Herz Die Wand besteht aus drei Schichten: dem inneren Endokard, dem mittleren Myokard und dem äußeren Epikard. Diese sind von einem doppelwandigen Beutel umgeben, dem Perikard.
Die innerste Schicht des Herzens wird Endokard genannt. Es besteht aus einem einfachen Plattenepithel und deckt Herzkammern und Herzklappen ab. Es schließt sich an das Endothel der Venen und Arterien des Herzens an und ist mit einer dünnen Bindegewebsschicht mit dem Myokard verbunden. [7] Das Endokard kann durch das Absondern von Endothelinen auch eine Rolle bei der Regulierung der Kontraktion des Herzens spielen Myokard. [7]

Die mittlere Schicht der Herzwand ist der Herzmuskel, der Herzmuskel - eine Schicht unwillkürlichen gestreiften Muskelgewebes, die von einem Kollagengerüst umgeben ist. Das Herzmuskelmuster ist elegant und komplex, da die Muskelzellen um die Herzkammern herumwirbeln und sich spiralförmig bewegen, wobei die äußeren Muskeln ein Muster der Figur 8 um den Vorhof und um die Basis der großen Gefäße bilden und die inneren Muskeln eine Figur bilden 8 um die beiden Ventrikel herum und in Richtung des Scheitels. Dieses komplexe Wirbelmuster ermöglicht es dem Herzen, Blut effektiver zu pumpen. [19459111[7]
Es gibt zwei Arten von Zellen im Herzmuskel: Muskelzellen, die sich leicht zusammenziehen können, und Schrittmacherzellen des Herzmuskels Leitungssystem. Die Muskelzellen bilden den Hauptteil (99%) der Zellen in den Vorhöfen und Ventrikeln. Diese kontraktilen Zellen sind durch interkalierte Scheiben miteinander verbunden, die eine schnelle Reaktion auf Impulse des Aktionspotentials der Schrittmacherzellen ermöglichen. Durch die interkalierten Bandscheiben wirken die Zellen als Syncytium und ermöglichen die Kontraktionen, die das Blut durch das Herz und in die Hauptarterien pumpen. [7] Die Schrittmacherzellen machen 1% der Zellen aus und bilden das Leitungssystem des Herzens. Sie sind im Allgemeinen viel kleiner als die kontraktilen Zellen und haben nur wenige Myofibrillen, wodurch sie nur eingeschränkt kontrahierbar sind. Ihre Funktion ist in vieler Hinsicht den Neuronen ähnlich. [7] Herzmuskelgewebe hat Autorhythmizität, die einzigartige Fähigkeit, ein Herzaktionspotential mit einer festen Rate auszulösen, das den Impuls schnell von Zelle zu Zelle ausbreitet, um die Kontraktion des gesamten Herzens auszulösen. [7]
Es gibt spezifische Proteine, die in Herzmuskelzellen exprimiert werden. [25][26] Diese sind meist mit Muskelkontraktionen assoziiert und binden an Aktin, Myosin, Tropomyosin und Troponin. Dazu gehören MYH6, ACTC1, TNNI3, CDH2 und PKP2. Weitere exprimierte Proteine sind MYH7 und LDB3, die auch im Skelettmuskel exprimiert werden. [27]
Pericardium
Das Perikard ist der Sack, der das Herz umgibt. Die zähe äußere Oberfläche des Perikards wird als Fasermembran bezeichnet. Diese wird von einer doppelten inneren Membran, der serösen Membran, ausgekleidet, die Perikardflüssigkeit produziert, um die Oberfläche des Herzens zu schmieren. Der Teil der serösen Membran, der an der Fasermembran befestigt ist, wird als Parietalperikard bezeichnet, während der Teil der serösen Membran, der am Herzen befestigt ist, als viszerales Perikard bekannt ist. Das Perikard ist vorhanden, um seine Bewegung gegen andere Strukturen innerhalb der Brust zu schmieren, um die Position des Herzens innerhalb der Brust zu stabilisieren und das Herz vor einer Infektion zu schützen. [29]
Koronarkreislauf

Wie alle Körperzellen muss Herzgewebe mit Sauerstoff, Nährstoffen und einer Möglichkeit zur Entfernung von Stoffwechselabfällen versorgt werden. Dies wird durch den koronaren Kreislauf erreicht, der Arterien, Venen und Lymphgefäße umfasst. Der Blutfluss durch die Herzkranzgefäße erfolgt in Spitzen und Tälern, die mit der Entspannung oder Kontraktion des Herzmuskels zusammenhängen. [19459122[7]
Herzgewebe erhält Blut aus zwei Arterien, die direkt über der Aortenklappe entstehen. Dies sind die linke Hauptkoronararterie und die rechte Koronararterie. Die linke Hauptkranzarterie spaltet sich kurz nach dem Verlassen der Aorta in zwei Gefäße auf, die linke anterior absteigende und die linke Arteria Circumflex. Die linke vordere absteigende Arterie versorgt das Herzgewebe und die Vorder- und Außenseite sowie das Septum des linken Ventrikels. Dies geschieht durch Verzweigung in kleinere Arterien - Diagonal- und Septumzweige. Der linke Circumflex bildet den Rücken und unter dem linken Ventrikel. Die rechte Koronararterie versorgt den rechten Vorhof, den rechten Ventrikel und die unteren hinteren Bereiche des linken Ventrikels. Die rechte Koronararterie versorgt auch den Atrioventrikulärknoten (bei etwa 90% der Menschen) und den Sinusknoten (bei etwa 60% der Menschen) mit Blut. Die rechte Koronararterie verläuft in einer Rille am hinteren Teil des Herzens und die linke anterior absteigende Arterie verläuft in einer Rille an der Vorderseite. Es gibt signifikante Unterschiede zwischen den Menschen in der Anatomie der Arterien, die das Herz versorgen. Die Arterien teilen sich an ihren Rändern in kleinere Äste, die sich an den Rändern jeder arteriellen Verteilung vereinen. [7]
The Der Koronarsinus ist eine große Vene, die in den rechten Vorhof abfließt und den größten Teil der venösen Drainage des Herzens aufnimmt. Es erhält Blut aus der großen Herzvene (die den linken Vorhof und beide Ventrikel empfängt), die hintere Herzvene (die den linken Ventrikel ablässt), die mittlere Herzvene (die Unterseite der linken und rechten Ventrikel abläuft) und klein Herzvenen. Die vorderen Herzvenen leiten die Vorderseite des rechten Ventrikels ab und direkt in den rechten Vorhof. [7]
Unter jeder der drei Herzschichten befinden sich kleine Lymphnetzwerke, die als Plexus bezeichnet werden. Diese Netzwerke sammeln sich in einem linken Haupt- und einem rechten Hauptstamm, die sich in der Nut zwischen den Ventrikeln auf der Herzoberfläche bewegen und kleinere Gefäße aufnehmen, wenn sie sich nach oben bewegen. Diese Gefäße wandern dann in die atrioventrikuläre Rille und erhalten ein drittes Gefäß, das den auf der Membran sitzenden Abschnitt des linken Ventrikels entwässert. Das linke Gefäß schließt sich an dieses dritte Gefäß an und wandert entlang der Lungenarterie und dem linken Atrium, bis es im unteren Tracheobronchialknoten endet. Das rechte Gefäß bewegt sich entlang des rechten Atriums und des Teils des rechten Ventrikels, der auf dem Zwerchfell sitzt. Normalerweise reist es dann vor der aufsteigenden Aorta und endet in einem brachiozephalen Knoten.
Nervenversorgung

Das Herz empfängt Nervensignale vom Vagusnerv und von den Sympathikusnerven Kofferraum. Diese Nerven wirken, um die Herzfrequenz zu beeinflussen, aber nicht zu kontrollieren. Sympathische Nerven beeinflussen auch die Kraft der Herzkontraktion. Signale, die sich entlang dieser Nerven bewegen, stammen von zwei gepaarten Herz-Kreislauf-Zentren in der Medulla oblongata. Der Vagusnerv des parasympathischen Nervensystems verringert die Herzfrequenz und Nerven aus dem sympathischen Rumpf erhöhen die Herzfrequenz. [7] Diese Nerven bilden ein Nervennetz, das über dem Herzen liegt und als Herzplexus bezeichnet wird. [19459128[7]
Der Vagusnerv ist ein langer, wandernder Nerv, der aus dem Hirnstamm austritt und eine parasympathische Stimulation für eine große Anzahl von Organen im Thorax und im Bauchraum einschließlich des Herzens bewirkt. Die Nerven des sympathischen Rumpfes treten durch die Thoraxganglien T1-T4 aus und wandern sowohl zu den Sinus- als auch zu den Atrioventrikelknoten sowie zu den Vorhöfen und Ventrikeln. Die Ventrikel werden durch sympathische Fasern reicher innerviert als parasympathische Fasern. Sympathische Stimulation bewirkt die Freisetzung des Neurotransmitters Norepinephrin (auch bekannt als Noradrenalin) an der neuromuskulären Verbindung der Herznerven. Dies verkürzt die Repolarisationsperiode und beschleunigt somit die Depolarisations- und Kontraktionsrate, was zu einer erhöhten Herzfrequenz führt. Es öffnet chemische oder ligandengesteuerte Natrium- und Calciumionenkanäle und ermöglicht so den Einstrom positiv geladener Ionen. [7] Noradrenalin bindet an den Beta-1-Rezeptor. [7]
Entwicklung

Das Herz ist das erste funktionelle Organ, das sich entwickelt und beginnt nach etwa drei Wochen in die Embryogenese zu schlagen und zu pumpen. Dieser frühe Start ist entscheidend für die spätere embryonale und pränatale Entwicklung.
Das Herz stammt vom splanchnopleurischen Mesenchym in der Neuralplatte, die die kardiogene Region bildet. Hier bilden sich zwei Endokardtuben, die zu einer primitiven Herzröhre, dem sogenannten Röhrenherz, verschmelzen. [35] Zwischen der dritten und vierten Woche verlängert sich die Herzröhre und faltet sich im Perikard zu einer S-Form. Dies bringt die Kammern und Hauptgefäße in die richtige Ausrichtung für das entwickelte Herz. Die weitere Entwicklung umfasst die Bildung und Umformung der Herzkammern in Form von Septen und Klappen. Bis zum Ende der fünften Woche sind die Septen abgeschlossen und die Herzklappen sind bis zur neunten Woche abgeschlossen. [7]
Vor der fünften Woche gibt es eine Öffnung im fötalen Herzen, die als Fetus bekannt ist Foramen Ovale. Das Foramen ovale ermöglichte es Blut im fötalen Herzen, direkt vom rechten Vorhof in den linken Vorhof zu gelangen, wodurch etwas Blut die Lunge umgehen konnte. Innerhalb von Sekunden nach der Geburt schließt ein Gewebeklappen, der als Septum primum bekannt ist und zuvor als Klappe fungierte, das Foramen ovale und bildet das typische Herzkreislaufmuster. An der Oberfläche des rechten Atriums befindet sich noch eine Vertiefung, an der sich das Foramen ovale befindet, die Fossa ovalis. [7]
Das embryonale Herz beginnt etwa 22 Tage nach der Empfängnis (5 Wochen nach der letzten normalen Menstruationsperiode, LMP) zu schlagen. Es beginnt mit einer Geschwindigkeit nahe der der Mutter, die etwa 75 bis 80 Schläge pro Minute (BPM) beträgt. Die embryonale Herzfrequenz beschleunigt sich dann und erreicht Anfang der siebten Woche (Anfang 9. Woche nach der LMP) eine Höchstgeschwindigkeit von 165–185 Schlägen / min. [36][37] Nach neun Wochen (Beginn des fötalen Stadiums) verlangsamt sich die Geschwindigkeit bei der Geburt ungefähr 145 (± 25) bpm. Es gibt keinen Unterschied zwischen weiblichen und männlichen Herzfrequenzen vor der Geburt. [38]
Physiology
Blutfluss
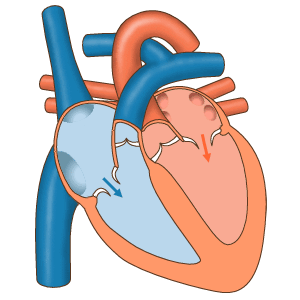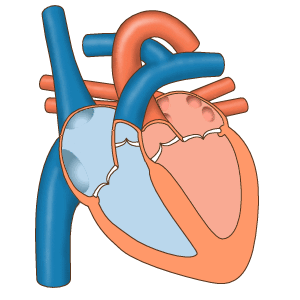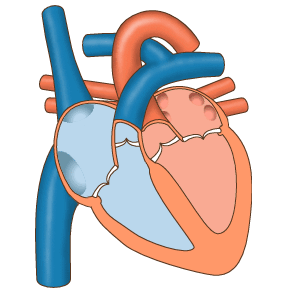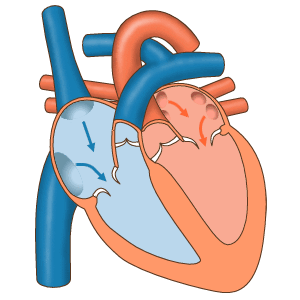
Das Herz fungiert als Pumpe im Kreislaufsystem, um einen kontinuierlichen Blutfluss bereitzustellen Durch den Körper. Dieser Kreislauf besteht aus dem systemischen Kreislauf zum und vom Körper und dem Lungenkreislauf in und aus der Lunge. Blut im Lungenkreislauf tauscht durch den Atmungsprozess Kohlendioxid gegen Sauerstoff in der Lunge. Die systemische Zirkulation transportiert dann Sauerstoff in den Körper und führt Kohlendioxid und relativ sauerstofffreies Blut in das Herz zurück, um es in die Lunge zu leiten. [7]
Das rechte Herz sammelt desoxygeniertes Blut aus zwei großen Adern, der oberen und unteren Venae cavae. Im rechten und linken Atrium sammelt sich kontinuierlich Blut. [7] Die obere Hohlvene leitet Blut von oberhalb des Zwerchfells ab und mündet in den oberen hinteren Teil des rechten Atriums. Die untere Hohlvene entleert das Blut unterhalb des Zwerchfells und mündet in den hinteren Teil des Atriums unterhalb der Öffnung für die obere Hohlvene. Unmittelbar über und in der Mitte der Öffnung der unteren Hohlvene befindet sich die Öffnung des dünnwandigen Koronarsinus. [7] Außerdem gibt der Koronarsinus desoxykathaltiges Blut vom Myokard in den rechten Vorhof zurück. Das Blut sammelt sich im rechten Atrium. Wenn sich der rechte Vorhof zusammenzieht, wird das Blut durch die Trikuspidalklappe in den rechten Ventrikel gepumpt. Wenn sich der rechte Ventrikel zusammenzieht, schließt sich die Trikuspidalklappe und das Blut wird durch die Pulmonalklappe in den Lungenrumpf gepumpt. Der Lungenrumpf teilt sich in Lungenarterien und zunehmend kleinere Arterien in der Lunge auf, bis er die Kapillaren erreicht. Wenn diese Alveolen passieren, wird Kohlendioxid gegen Sauerstoff ausgetauscht. Dies geschieht durch den passiven Diffusionsprozess.
Im linken Herzen wird mit Sauerstoff angereichertes Blut über die Lungenvenen in den linken Atrium zurückgeführt. Es wird dann durch die Mitralklappe in den linken Ventrikel und durch die Aortenklappe in die Aorta zur systemischen Zirkulation gepumpt. Die Aorta ist eine große Arterie, die sich in viele kleinere Arterien, Arteriolen und letztendlich Kapillaren verzweigt. In den Kapillaren werden den Körperzellen Sauerstoff und Nährstoffe aus dem Blut für den Stoffwechsel zugeführt und gegen Kohlendioxid und Abfallprodukte ausgetauscht. [7] Das jetzt mit Sauerstoff angereicherte Kapillarblut gelangt in die Venulen und Venen, die sich schließlich in der oberen und unteren Vena cavae sammeln und in das rechte Herz.
Herzzyklus

Der Herzzyklus bezieht sich auf die Abfolge von Ereignissen, bei denen sich das Herz mit jedem Herzschlag zusammenzieht und entspannt. Die Zeitspanne, während der sich die Ventrikel zusammenziehen, wodurch Blut in die Aorta und die Hauptlungenarterie gedrückt wird, wird als Systole bezeichnet, während die Zeitspanne, während der sich die Ventrikel entspannen und sich mit Blut füllen, als Diastole bezeichnet wird. Die Vorhöfe und die Ventrikel arbeiten zusammen, so dass in der Systole, wenn sich die Ventrikel zusammenziehen, die Atrien entspannt werden und Blut sammeln. Wenn die Herzkammern in der Diastole entspannt sind, ziehen sich die Vorhöfe zusammen, um Blut in die Herzkammern zu pumpen. Diese Koordination gewährleistet, dass Blut effizient in den Körper gepumpt wird. [7]
Zu Beginn des Herzzyklus entspannen sich die Ventrikel. Dabei füllen sie Blut, das durch die offenen Mitral- und Trikuspidalklappen strömt. Nachdem die Ventrikel den größten Teil ihrer Füllung abgeschlossen haben, ziehen sich die Vorhöfe zusammen, wodurch weiteres Blut in die Ventrikel gedrückt und die Pumpe angefüllt wird. Als nächstes beginnen sich die Ventrikel zusammenzuziehen. Wenn der Druck in den Hohlräumen der Ventrikel ansteigt, werden die Mitral- und Trikuspidalklappen zwangsweise geschlossen. Wenn der Druck in den Ventrikeln weiter ansteigt und den Druck mit der Aorta und den Lungenarterien übersteigt, öffnen sich die Aorta- und Pulmonalklappen. Blut wird aus dem Herzen ausgestoßen, wodurch der Druck in den Ventrikeln abfällt. Gleichzeitig füllen sich die Vorhöfe wieder auf, wenn das Blut durch die obere und untere Hohlvene in den rechten Vorhof und durch die Lungenvenen in den linken Vorhof fließt. Wenn der Druck in den Ventrikeln schließlich unter den Druck in der Aorta und den Lungenarterien fällt, schließen sich die Aorta- und die Lungenklappen. Die Ventrikel beginnen sich zu entspannen, die Mitral- und Trikuspidalklappen öffnen sich und der Zyklus beginnt von neuem.
Herzzeitvolumen

Das Herzzeitvolumen (CO) ist die Messung der von jedem Ventrikel gepumpten Blutmenge (Schlagvolumen) in einer Minute. Dies wird berechnet, indem das Schlagvolumen (SV) mit den Schlägen pro Minute der Herzfrequenz (HR) multipliziert wird. Also: CO = SV x HR. [7]
Das Herzzeitvolumen wird durch die Körperoberfläche auf die Körpergröße normiert und als Herzindex bezeichnet.
Die durchschnittliche Herzleistung beträgt bei einem durchschnittlichen Schlagvolumen von etwa 70 ml 5,25 l / min, mit einem normalen Bereich von 4,0–8,0 l / min. [7] Das Schlagvolumen wird normalerweise unter Verwendung eines Echokardiogramms gemessen und kann sein beeinflusst durch die Größe des Herzens, den physischen und psychischen Zustand des Individuums, Geschlecht, Kontraktilität, Kontraktionsdauer, Vorspannung und Nachlast. [7]
Die Vorspannung bezieht sich auf den Fülldruck der Vorhöfe das Ende der Diastole, wenn die Ventrikel voll sind. Ein Hauptfaktor ist, wie lange es dauert, bis die Ventrikel gefüllt sind: Wenn sich die Ventrikel häufiger zusammenziehen, bleibt weniger Zeit zum Füllen und die Vorspannung ist geringer. [7] Die Vorspannung kann auch durch das Blutvolumen einer Person beeinflusst werden. Die Kraft jeder Kontraktion des Herzmuskels ist proportional zur Vorspannung, die als Frank-Starling-Mechanismus bezeichnet wird. Dies besagt, dass die Kontraktionskraft direkt proportional zu der Anfangslänge der Muskelfaser ist, was bedeutet, dass sich ein Ventrikel umso stärker zusammenzieht, je mehr er gedehnt wird. [7]
Afterload oder wie viel Druck Das Herz muss erzeugen, um Blut an der Systole auszustoßen, wird durch vaskulären Widerstand beeinflusst. Sie kann durch Verengung der Herzklappen (Stenose) oder Kontraktion oder Entspannung der peripheren Blutgefäße beeinflusst werden. [7]
Die Stärke der Herzmuskelkontraktionen steuert das Schlagvolumen. Dies kann durch als inotropes Mittel bezeichnete Mittel positiv oder negativ beeinflußt werden. [40] Diese Mittel können Folge von Veränderungen im Körper sein oder als Arzneimittel als Bestandteil einer Behandlung einer medizinischen Störung oder insbesondere als Lebenshilfe verabreicht werden auf Intensivstationen. Inotrope, die die Kontraktionskraft erhöhen, sind "positive" Inotrope und umfassen sympathische Mittel wie Adrenalin, Noradrenalin und Dopamin. [41] "Negative" Inotrope verringern die Kontraktionskraft und schließen Calciumkanalblocker ein. [40]
Elektrische Leitung

] Der normale rhythmische Herzschlag, Sinusrhythmus genannt, wird vom Sinusknoten, dem Herzschrittmacher des Herzens, bestimmt. Hier wird ein elektrisches Signal erzeugt, das sich durch das Herz bewegt und den Herzmuskel zusammenzieht.
The sinoatrial node is found in the upper part of the right atrium near to the junction with the superior vena cava.[42] The electrical signal generated by the sinoatrial node travels through the right atrium in a radial way that is not completely understood. It travels to the left atrium via Bachmann's bundle, such that the muscles of the left and right atria contract together.[43][44][45] The signal then travels to the atrioventricular node. This is found at the bottom of the right atrium in the atrioventricular septum—the boundary between the right atrium and the left ventricle. The septum is part of the cardiac skeleton, tissue within the heart that the electrical signal cannot pass through, which forces the signal to pass through the atrioventricular node only.[7] The signal then travels along the bundle of His to left and right bundle branches through to the ventricles of the heart. In the ventricles the signal is carried by specialized tissue called the Purkinje fibers which then transmit the electric charge to the heart muscle.[46]

Heart rate

The normal resting heart rate is called the sinus rhythm, created and sustained by the sinoatrial node, a group of pacemaking cells found in the wall of the right atrium. Cells in the sinoatrial node do this by creating an action potential. The cardiac action potential is created by the movement of specific electrolytes into and out of the pacemaker cells. The action potential then spreads to nearby cells.
When the sinoatrial cells are resting, they have a negative charge on their membranes. However a rapid influx of sodium ions causes the membrane's charge to become positive. This is called depolarisation and occurs spontaneously.[7] Once the cell has a sufficiently high charge, the sodium channels close and calcium ions then begin to enter the cell, shortly after which potassium begins to leave it. All the ions travel through ion channels in the membrane of the sinoatrial cells. The potassium and calcium start to move out of and into the cell only once it has a sufficiently high charge, and so are called voltage-gated. Shortly after this, the calcium channels close and potassium channels open, allowing potassium to leave the cell. This causes the cell to have a negative resting charge and is called repolarization. When the membrane potential reaches approximately −60 mV, the potassium channels close and the process may begin again.[7]
The ions move from areas where they are concentrated to where they are not. For this reason sodium moves into the cell from outside, and potassium moves from within the cell to outside the cell. Calcium also plays a critical role. Their influx through slow channels means that the sinoatrial cells have a prolonged "plateau" phase when they have a positive charge. A part of this is called the absolute refractory period. Calcium ions also combine with the regulatory protein troponin C in the troponin complex to enable contraction of the cardiac muscle, and separate from the protein to allow relaxation.[48]
The adult resting heart rate ranges from 60 to 100 bpm. The resting heart rate of a newborn can be 129 beats per minute (bpm) and this gradually decreases until maturity.[49] An athlete's heart rate can be lower than 60 bpm. During exercise the rate can be 150 bpm with maximum rates reaching from 200 to 220 bpm.[7]
Influences
The normal sinus rhythm of the heart, giving the resting heart rate, is influenced a number of factors. The cardiovascular centres in the brainstem that control the sympathetic and parasympathetic influences to the heart through the vagus nerve and sympathetic trunk.[50] These cardiovascular centres receive input from a series of receptors including baroreceptors, sensing stretch the stretching of blood vessels and chemoreceptors, sensing the amount of oxygen and carbon dioxide in the blood and its pH. Through a series of reflexes these help regulate and sustain blood flow.[7]
Baroreceptors are stretch receptors located in the aortic sinus, carotid bodies, the venae cavae, and other locations, including pulmonary vessels and the right side of the heart itself. Baroreceptors fire at a rate determined by how much they are stretched, which is influenced by blood pressure, level of physical activity, and the relative distribution of blood. With increased pressure and stretch, the rate of baroreceptor firing increases, and the cardiac centers decrease sympathetic stimulation and increase parasympathetic stimulation . As pressure and stretch decrease, the rate of baroreceptor firing decreases, and the cardiac centers increase sympathetic stimulation and decrease parasympathetic stimulation.[7] There is a similar reflex, called the atrial reflex or Bainbridge reflex, associated with varying rates of blood flow to the atria. Increased venous return stretches the walls of the atria where specialized baroreceptors are located. However, as the atrial baroreceptors increase their rate of firing and as they stretch due to the increased blood pressure, the cardiac center responds by increasing sympathetic stimulation and inhibiting parasympathetic stimulation to increase heart rate. The opposite is also true.[7] Chemoreceptors present in the carotid body or adjacent to the aorta in an aortic body respond to the blood's oxygen, carbon dioxide levels. Low oxygen or high carbon dioxide will stimulate firing of the receptors.
Exercise and fitness levels, age, body temperature, basal metabolic rate, and even a person's emotional state can all affect the heart rate. High levels of the hormones epinephrine, norepinephrine, and thyroid hormones can increase the heart rate. The levels of electrolytes including calcium, potassium, and sodium can also influence the speed and regularity of the heart rate; low blood oxygen, low blood pressure and dehydration may increase it.[7]
Clinical significance
Diseases


Cardiovascular diseases, which include diseases of the heart, are the leading cause of death worldwide.[53] The majority of cardiovascular disease is noncommunicable and related to lifestyle and other factors, becoming more prevalent with ageing.[53] Heart disease is a major cause of death, accounting for an average of 30% of all deaths in 2008, globally.[11] This rate varies from a lower 28% to a high 40% in high-income countries.[12] Doctors that specialise in the heart are called cardiologists. Many other medical professionals are involved in treating diseases of the heart, including doctors such as general practitioners, cardiothoracic surgeons and intensivists, and allied health practitioners including physiotherapists and dieticians.[54]
Ischaemic heart disease
Coronary artery disease, also known as ischaemic heart disease, is caused by atherosclerosis—a build-up of fatty material along the inner walls of the arteries. These fatty deposits known as atherosclerotic plaques narrow the coronary arteries, and if severe may reduce blood flow to the heart.[55] If a narrowing (or stenosis) is relatively minor then the patient may not experience any symptoms. Severe narrowings may cause chest pain (angina) or breathlessness during exercise or even at rest. The thin covering of an atherosclerotic plaque can rupture, exposing the fatty centre to the circulating blood. In this case a clot or thrombus can form, blocking the artery, and restricting blood flow to an area of heart muscle causing a myocardial infarction (a heart attack) or unstable angina. In the worst case this may cause cardiac arrest, a sudden and utter loss of output from the heart.Obesity, high blood pressure, uncontrolled diabetes, smoking and high cholesterol can all increase the risk of developing atherosclerosis and coronary artery disease.[53][55]
Heart failure
Heart failure is defined as a condition in which the heart is unable to pump enough blood to meet the demands of the body.[58] Patients with heart failure may experience breathlessness especially when lying flat, as well as ankle swelling, known as peripheral oedema. Heart failure is the end result of many diseases affecting the heart, but is most commonly associated with ischaemic heart disease, valvular heart disease, or high blood pressure. Less common causes include various cardiomyopathies. Heart failure is frequently associated with weakness of the heart muscle in the ventricles (systolic heart failure), but can also be seen in patients with heart muscle that is strong but stiff (diastolic heart failure). The condition may affect the left ventricle (causing predominantly breathlessness), the right ventricle (causing predominantly swelling of the legs and an elevated jugular venous pressure), or both ventricles. Patients with heart failure are at higher risk of developing dangerous heart rhythm disturbances or arrhythmias.[58]
Cardiomyopathies
Cardiomyopathies are diseases affecting the muscle of the heart. Some cause abnormal thickening of the heart muscle (hypertrophic cardiomyopathy), some cause the heart to abnormally expand and weaken (dilated cardiomyopathy), some cause the heart muscle to become stiff and unable to fully relax between contractions (restrictive cardiomyopathy) and some make the heart prone to abnormal heart rhythms (arrhythmogenic cardiomyopathy). These conditions are often genetic and can be inherited, but some such as dilated cardiomyopathy may be caused by damage from toxins such as alcohol. Some cardiomyopathies such as hypertrophic cardiomopathy are linked to a higher risk of sudden cardiac death, particularly in athletes.[7] Many cardiomyopathies can lead to heart failure in the later stages of the disease.[58]
Valvular heart disease
Healthy heart valves allow blood to flow easily in one direction, but prevent it from flowing in the other direction. Diseased heart valves may have a narrow opening and therefore restrict the flow of blood in the forward direction (referred to as a stenotic valve), or may allow blood to leak in the reverse direction (referred to as valvular regurgitation). Valvular heart disease may cause breathlessness, blackouts, or chest pain, but may be asymptomatic and only detected on a routine examination by hearing abnormal heart sounds or a heart murmur. In the developed world, valvular heart disease is most commonly caused by degeneration secondary to old age, but may also be caused by infection of the heart valves (endocarditis). In some parts of the world rheumatic heart disease is a major cause of valvular heart disease, typically leading to mitral or aortic stenosis and caused by the body's immune system reacting to a streptococcal throat infection.[59]
Cardiac arrhythmias
While in the healthy heart, waves of electrical impulses originate in the sinus node before spreading to the rest of the atria, the atrioventricular node, and finally the ventricles (referred to as a normal sinus rhythm), this normal rhythm can be disrupted. Abnormal heart rhythms or arrhythmias may be asymptomatic or may cause palpitations, blackouts, or breathlessness. Some types of arrhythmia such as atrial fibrillation increase the long term risk of stroke.[61]
Some arrhythmias cause the heart to beat abnormally slowly, referred to as a bradycardia or bradyarrhythmia. This may be caused by an abnormally slow sinus node or damage within the cardiac conduction system (heart block).[62] In other arrhythmias the heart may beat abnormally rapidly, referred to as a tachycardia or tachyarrhythmia. These arrhythmias can take many forms and can originate from different structures within the heart—some arise from the atria (e.g. atrial flutter), some from the atrioventricular node (e.g. AV nodal re-entrant tachycardia) whilst others arise from the ventricles (e.g. ventricular tachycardia). Some tachyarrhythmias are caused by scarring within the heart (e.g. some forms of ventricular tachycardia), others by an irritable focus (e.g. focal atrial tachycardia), while others are caused by additional abnormal conduction tissue that has been present since birth (e.g. Wolff-Parkinson-White syndrome). The most dangerous form of heart racing is ventricular fibrillation, in which the ventricles quiver rather than contract, and which if untreated is rapidly fatal.[63]
Pericardial disease
The sack which surrounds the heart, called the pericardium, can become inflamed in a condition known as pericarditis. This condition typically causes chest pain that may spread to the back, and is often caused by a viral infection (glandular fever, cytomegalovirus, or coxsackievirus). Fluid can build up within the pericardial sack, referred to as a pericardial effusion. Pericardial effusions often occur secondary to pericarditis, kidney failure, or tumours, and frequently do not cause any symptoms. However, large effusions or effusions which accumulate rapidly can compress the heart in a condition known as cardiac tamponade, causing breathlessness and potentially fatal low blood pressure. Fluid can be removed from the pericardial space for diagnosis or to relieve tamponade using a syringe in a procedure called pericardiocentesis.
Congenital heart disease
Some people are born with hearts that are abnormal and these abnormalities are known as congenital heart defects. They may range from the relatively minor (e.g. patent foramen ovale, arguably a variant of normal) to serious life-threatening abnormalities (e.g. hypoplastic left heart syndrome). Common abnormalities include those that affect the heart muscle that separates the two side of the heart (a 'hole in the heart' e.g. ventricular septal defect). Other defects include those affecting the heart valves (e.g. congenital aortic stenosis), or the main blood vessels that lead from the heart (e.g. coarctation of the aorta). More complex syndromes are seen that affect more than one part of the heart (e.g. Tetralogy of Fallot).
Some congenital heart defects allow blood that is low in oxygen that would normally be returned to the lungs to instead be pumped back to the rest of the body. These are known as cyanotic congenital heart defects and are often more serious. Major congenital heart defects are often picked up in childhood, shortly after birth, or even before a child is born (e.g. transposition of the great arteries), causing breathlessness and a lower rate of growth. More minor forms of congenital heart disease may remain undetected for many years and only reveal themselves in adult life (e.g. atrial septal defect).[65]
Diagnosis
Heart disease is diagnosed by the taking of a medical history, a cardiac examination, and further investigations, including blood tests, echocardiograms, ECGs and imaging. Other invasive procedures such as cardiac catheterisation can also play a role.
Examination
The cardiac examination includes inspection, feeling the chest with the hands (palpation) and listening with a stethoscope (auscultation).[68] It involves assessment of signs that may be visible on a person's hands (such as splinter haemorrhages), joints and other areas. A person's pulse is taken, usually at the radial artery near the wrist, in order to assess for the rhythm and strength of the pulse. The blood pressure is taken, using either a manual or automatic sphygmomanometer or using a more invasive measurement from within the artery. Any elevation of the jugular venous pulse is noted. A person's chest is felt for any transmitted vibrations from the heart, and then listened to with a stethoscope.
Heart sounds

The closure of the heart valves causes the heart sounds.
Typically, healthy hearts have only two audible heart sounds, called S1 and S2. The first heart sound S1, is the sound created by the closing of the atrioventricular valves during ventricular contraction and is normally described as "lub". The second heart sound, S2, is the sound of the semilunar valves closing during ventricular diastole and is described as "dub".[7] Each sound consists of two components, reflecting the slight difference in time as the two valves close.[70] S2 may split into two distinct sounds, either as a result of inspiration or different valvular or cardiac problems.[70] Additional heart sounds may also be present and these give rise to gallop rhythms. A third heart sound, S3 usually indicates an increase in ventricular blood volume. A fourth heart sound S4 is referred to as an atrial gallop and is produced by the sound of blood being forced into a stiff ventricle. The combined presence of S3 and S4 give a quadruple gallop.[7]
Heart murmurs are abnormal heart sounds which can be either related to disease or benign, and there are several kinds. There are normally two heart sounds, and abnormal heart sounds can either be extra sounds, or "murmurs" related to the flow of blood between the sounds. Murmurs are graded by volume, from 1 (the quietest), to 6 (the loudest), and evaluated by their relationship to the heart sounds, position in the cardiac cycle, and additional features such as their radiation to other sites, changes with a person's position, the frequency of the sound as determined by the side of the stethoscope by which they are heard, and site at which they are heard loudest. Murmurs may be caused by damaged heart valves, congenital heart disease such as ventricular septal defects, or may be heard in normal hearts. A different type of sound, a pericardial friction rub can be heard in cases of pericarditis where the inflamed membranes can rub together.
Blood tests
Blood tests play an important role in the diagnosis and treatment of many cardiovascular conditions.
Troponin is a sensitive biomarker for a heart with insufficient blood supply. It is released 4–6 hours after injury, and usually peaks at about 12–24 hours.[41] Two tests of troponin are often taken—one at the time of initial presentation, and another within 3–6 hours,[72] with either a high level or a significant rise being diagnostic. A test for brain natriuretic peptide (BNP) can be used to evaluate for the presence of heart failure, and rises when there is increased demand on the left ventricle. These tests are considered biomarkers because they are highly specific for cardiac disease. Testing for the MB form of creatine kinase provides information about the heart's blood supply, but is used less frequently because it is less specific and sensitive.
Other blood tests are often taken to help understand a person's general health and risk factors that may contribute to heart disease. These often include a full blood count investigating for anaemia, and basic metabolic panel that may reveal any disturbances in electrolytes. A coagulation screen is often required to ensure that the right level of anticoagulation is given. Fasting lipids and fasting blood glucose (or an HbA1c level) are often ordered to evaluate a person's cholesterol and diabetes status, respectively.
Electrocardiogram

Using surface electrodes on the body, it is possible to record the electrical activity of the heart. This tracing of the electrical signal is the electrocardiogram (ECG) or (EKG). An ECG is a bedside test and involves the placement of ten leads on the body. This produces a "12 lead" ECG (three extra leads are calculated mathematically, and one lead is a ground).
There are five prominent features on the ECG: the P wave (atrial depolarisation), the QRS complex (ventricular depolarisation[h]) and the T wave (ventricular repolarisation).[7] As the heart cells contract, they create a current that travels through the heart. A downward deflection on the ECG implies cells are becoming more positive in charge ("depolarising") in the direction of that lead, whereas an upward inflection implies cells are becoming more negative ("repolarising") in the direction of the lead. This depends on the position of the lead, so if a wave of depolarising moved from left to right, a lead on the left would show a negative deflection, and a lead on the right would show a positive deflection. The ECG is a useful tool in detecting rhythm disturbances and in detecting insufficient blood supply to the heart. Sometimes abnormalities are suspected, but not immediately visible on the ECG. Testing when exercising can be used to provoke an abnormality, or an ECG can be worn for a longer period such as a 24-hour Holter monitor if a suspected rhythm abnormality is not present at the time of assessment.
Imaging
Several imaging methods can be used to assess the anatomy and function of the heart, including ultrasound (echocardiography), angiography, CT scans, MRI and PET. An echocardiogram is an ultrasound of the heart used to measure the heart's function, assess for valve disease, and look for any abnormalities. Echocardiography can be conducted by a probe on the chest ("transthoracic") or by a probe in the esophagus ("transoesophageal"). A typical echocardiography report will include information about the width of the valves noting any stenosis, whether there is any backflow of blood (regurgitation) and information about the blood volumes at the end of systole and diastole, including an ejection fraction, which describes how much blood is ejected from the left and right ventricles after systole. Ejection fraction can then be obtained by dividing the volume ejected by the heart (stroke volume) by the volume of the filled heart (end-diastolic volume).[77] Echocardiograms can also be conducted under circumstances when the body is more stressed, in order to examine for signs of lack of blood supply. This cardiac stress test involves either direct exercise, or where this is not possible, injection of a drug such as dobutamine.
CT scans, chest X-rays and other forms of imaging can help evaluate the heart's size, evaluate for signs of pulmonary oedema, and indicate whether there is fluid around the heart. They are also useful for evaluating the aorta, the major blood vessel which leaves the heart.
Treatment
Diseases affecting the heart can be treated by a variety of methods including lifestyle modification, drug treatment, and surgery.
Ischaemic heart disease
Narrowings of the coronary arteries (ischaemic heart disease) are treated to relieve symptoms of chest pain caused by a partially narrowed artery (angina pectoris), to minimise heart muscle damage when an artery is completely occluded (myocardial infarction), or to prevent a myocardial infarction from occurring. Medications to improve angina symptoms include nitroglycerin, beta blockers, and calcium channel blockers, while preventative treatments include antiplatelets such as aspirin and statins, lifestyle measures such as stopping smoking and weight loss, and treatment of risk factors such as high blood pressure and diabetes.[78]
In addition to using medications, narrowed heart arteries can be treated by expanding the narrowings or redirecting the flow of blood to bypass an obstruction. This may be performed using a percutaneous coronary intervention, during which narrowings can be expanded by passing small balloon-tipped wires into the coronary arteries, inflating the balloon to expand the narrowing, and sometimes leaving behind a metal scaffold known as a stent to keep the artery open.[79]
If the narrowings in coronary arteries are unsuitable for treatment with a percutaneous coronary intervention, open surgery may be required. A coronary artery bypass graft can be performed, whereby a blood vessel from another part of the body (the saphenous vein, radial artery, or internal mammary artery) is used to redirect blood from a point before the narrowing (typically the aorta) to a point beyond the obstruction.[79]
Valvular heart disease
Diseased heart valves that have become abnormally narrow or abnormally leaky may require surgery. This is traditionally performed as an open surgical procedure to replace the damaged heart valve with a tissue or metallic prosthetic valve. In some circumstances, the tricuspid or mitral valves can be repaired surgically, avoiding the need for a valve replacement. Heart valves can also be treated percutaneously, using techniques that share many similarities with percutaneous coronary intervention. Transcatheter aortic valve replacement is increasingly used for patients consider very high risk for open valve replacement.[59]
Cardiac arrhythmias
Abnormal heart rhythms (arrhythmias) can be treated using antiarrhythmic drugs. These may work by manipulating the flow of electrolytes across the cell membrane (such as calcium channel blockers, sodium channel blockers, amiodarone, or digoxin), or modify the autonomic nervous system's effect on the heart (beta blockers and atropine). In some arrhythmias such as atrial fibrillation which increase the risk of stroke, this risk can be reduced using anticoagulants such as warfarin or novel oral anticoagualants.[61]
If medications fail to control an arrhythmia, another treatment option may be catheter ablation. In these procedures, wires are passed from a vein or artery in the leg to the heart to find the abnormal area of tissue that is causing the arrhythmia. The abnormal tissue can be intentionally damaged, or ablated, by heating or freezing to prevent further heart rhythm disturbances. Whilst the majority of arrhythmias can be treated using minimally invasive catheter techniques, some arrhythmias (particularly atrial fibrillation) can also be treated using open or thoracoscopic surgery, either at the time of other cardiac surgery or as a standalone procedure. A cardioversion, whereby an electric shock is used to stun the heart out of an abnormal rhythm, may also be used.
Cardiac devices in the form of pacemakers or implantable defibrillators may also be required to treat arrhythmias. Pacemakers, comprising a small battery powered generator implanted under the skin and one or more leads that extend to the heart, are most commonly used to treat abnormally slow heart rhythms.[62] Implantable defibrillators are used to treat serious life-threatening rapid heart rhythms. These devices monitor the heart, and if dangerous heart racing is detected can automatically deliver a shock to restore the heart to a normal rhythm. Implantable defibrillators are most commonly used in patients with heart failure, cardiomyopathies, or inherited arrhythmia syndromes.
Heart failure
As well as addressing the underlying cause for a patient's heart failure (most commonly ischaemic heart disease or hypertension), the mainstay of heart failure treatment is with medication. These include drugs to prevent fluid from accumulating in the lungs by increasing the amount of urine a patient produces (diuretics), and drugs that attempt to preserve the pumping function of the heart (beta blockers, ACE inhibitors and mineralocorticoid receptor antagonists).[58]
In some patients with heart failure, a specialised pacemaker known as cardiac resynchronisation therapy can be used to improve the heart's pumping efficiency.[62] These devices are frequently combined with a defibrillator. In very severe cases of heart failure, a small pump called a ventricular assist device may be implanted which supplements the heart's own pumping ability. In the most severe cases, a cardiac transplant may be considered.[58]
History
Ancient

Humans have known about the heart since ancient times, although its precise function and anatomy were not clearly understood.[81] From the primarily religious views of earlier societies towards the heart, ancient Greeks are considered to have been the primary seat of scientific understanding of the heart in the ancient world.[82][83][84]Aristotle considered the heart to be organ responsible for creating blood; Plato considered the heart as the source of circulating blood and Hippocrates noted blood circulating cyclically from the body through the heart to the lungs.[82][84]Erasistratos (304–250 BCE) noted the heart as a pump, causing dilation of blood vessels, and noted that arteries and veins both radiate from the heart, becoming progressively smaller with distance, although he believed they were filled with air and not blood. He also discovered the heart valves.[82]
The Greek physician Galen (2nd century CE) knew blood vessels carried blood and identified venous (dark red) and arterial (brighter and thinner) blood, each with distinct and separate functions.[82] Galen, noting the heart as the hottest organ in the body, concluded that it provided heat to the body.[84] The heart did not pump blood around, the heart's motion sucked blood in during diastole and the blood moved by the pulsation of the arteries themselves.[84] Galen believed the arterial blood was created by venous blood passing from the left ventricle to the right through 'pores' between the ventricles.[81] Air from the lungs passed from the lungs via the pulmonary artery to the left side of the heart and created arterial blood.[84]
These ideas went unchallenged for almost a thousand years.[81][84]
Pre-modern
The earliest descriptions of the coronary and pulmonary circulation systems can be found in the Commentary on Anatomy in Avicenna's Canonpublished in 1242 by Ibn al-Nafis.[85] In his manuscript, al-Nafis wrote that blood passes through the pulmonary circulation instead of moving from the right to the left ventricle as previously believed by Galen.[86] His work was later translated into Latin by Andrea Alpago.[87]
In Europe, the teachings of Galen continued to dominate the academic community and his doctrines were adopted as the official canon of the Church. Andreas Vesalius questioned some of Galen's beliefs of the heart in De humani corporis fabrica (1543), but his magnum opus was interpreted as a challenge to the authorities and he was subjected to a number of attacks.[88]Michael Servetus wrote in Christianismi Restitutio (1553) that blood flows from one side of the heart to the other via the lungs.[88]
Modern

A breakthrough in understanding the flow of blood through the heart and body came with the publication of De Motu Cordis (1628) by the English physician William Harvey. Harvey's book completely describes the systemic circulation and the mechanical force of the heart, leading to an overhaul of the Galenic doctrines.[84]Otto Frank (1865–1944) was a German physiologist; among his many published works are detailed studies of this important heart relationship. Ernest Starling (1866–1927) was an important English physiologist who also studied the heart. Although they worked largely independently, their combined efforts and similar conclusions have been recognized in the name "Frank–Starling mechanism".[7]
Although Purkinje fibers and the bundle of His were discovered as early as the 19th century, their specific role in the electrical conduction system of the heart remained unknown until Sunao Tawara published his monograph, titled Das Reizleitungssystem des Säugetierherzensin 1906. Tawara's discovery of the atrioventricular node prompted Arthur Keith and Martin Flack to look for similar structures in the heart, leading to their discovery of the sinoatrial node several months later. These structures form the anatomical basis of the electrocardiogram, whose inventor, Willem Einthoven, was awarded the Nobel Prize in Medicine or Physiology in 1924.[89]
The first successful heart transplantation was performed in 1967 by the South African surgeon Christiaan Barnard at Groote Schuur Hospital in Cape Town. This marked an important milestone in cardiac surgery, capturing the attention of both the medical profession and the world at large. However, long-term survival rates of patients were initially very low. Louis Washkansky, the first recipient of a donated heart, died 18 days after the operation while other patients did not survive for more than a few weeks.[90] The American surgeon Norman Shumway has been credited for his efforts to improve transplantation techniques, along with pioneers Richard Lower, Vladimir Demikhov and Adrian Kantrowitz. As of March 2000, more than 55,000 heart transplantations have been performed worldwide.[91]
By the middle of the 20th century, heart disease had surpassed infectious disease as the leading cause of death in the United States, and it is currently the leading cause of deaths worldwide. Since 1948, the ongoing Framingham Heart Study has shed light on the effects of various influences on the heart, including diet, exercise, and common medications such as aspirin. Although the introduction of ACE inhibitors and beta blockers has improved the management of chronic heart failure, the disease continues to be an enormous medical and societal burden, with 30 to 40% of patients dying within a year of receiving the diagnosis.[92]
Society and culture
Symbolism
As one of the vital organs, the heart was long identified as the center of the entire body, the seat of life, or emotion, or reason, will, intellect, purpose or the mind.[93] The heart is an emblematic symbol in many religions, signifying "truth, conscience or moral courage in many religions—the temple or throne of God in Islamic and Judeo-Christian thought; the divine centre, or atman, and the third eye of transcendent wisdom in Hinduism; the diamond of purity and essence of the Buddha; the Taoist centre of understanding."[93]
In the Hebrew Bible, the word for heart, levis used in these meanings, as the seat of emotion, the mind, and referring to the anatomical organ. It is also connected in function and symbolism to the stomach.[94]
An important part of the concept of the soul in Ancient Egyptian religion was thought to be the heart, or ib. The ib or metaphysical heart was believed to be formed from one drop of blood from the child's mother's heart, taken at conception.[95] To ancient Egyptians, the heart was the seat of emotion, thought, will, and intention. This is evidenced by Egyptian expressions which incorporate the word ibsuch as Awi-ib for "happy" (literally, "long of heart"), Xak-ib for "estranged" (literally, "truncated of heart").[96] In Egyptian religion, the heart was the key to the afterlife. It was conceived as surviving death in the nether world, where it gave evidence for, or against, its possessor. It was thought that the heart was examined by Anubis and a variety of deities during the Weighing of the Heart ceremony. If the heart weighed more than the feather of Maat, which symbolized the ideal standard of behavior. If the scales balanced, it meant the heart's possessor had lived a just life and could enter the afterlife; if the heart was heavier, it would be devoured by the monster Ammit.[97]
The Chinese character for "heart", 心, derives from a comparatively realistic depiction of a heart (indicating the heart chambers) in seal script.[98] The Chinese word xīn also takes the metaphorical meanings of "mind", "intention", or "core".[99]In Chinese medicine, the heart is seen as the center of 神 shén "spirit, consciousness".[100] The heart is associated with the small intestine, tongue, governs the six organs and five viscera, and belongs to fire in the five elements.[101]
The Sanskrit word for heart is hṛd or hṛdayafound in the oldest surviving Sanskrit text, the Rigveda. In Sanskrit, it may mean both the anatomical object and "mind" or "soul", representing the seat of emotion. Hrd may be a cognate of the word for heart in Greek, Latin, and English.[102][103]
Many classical philosophers and scientists, including Aristotle, considered the heart the seat of thought, reason, or emotion, often disregarding the brain as contributing to those functions.[104] The identification of the heart as the seat of emotions in particular is due to the Roman physician Galen, who also located the seat of the passions in the liver, and the seat of reason in the brain.[105]
The heart also played a role in the Aztec system of belief. The most common form of human sacrifice practiced by the Aztecs was heart-extraction. The Aztec believed that the heart (tona) was both the seat of the individual and a fragment of the Sun's heat (istli). To this day, the Nahua consider the Sun to be a heart-soul (tona-tiuh): "round, hot, pulsating".[106]
In Catholicism, there has been a long tradition of veneration of the heart, stemming from worship of the wounds of Jesus Christ which gained prominence from the mid sixteenth century.[107] This tradition influenced the development of the medieval Christian devotion to the Sacred Heart of Jesus and the parallel worship of Immaculate Heart of Mary, made popular by John Eudes.[108]
The expression of a broken heart is a cross-cultural reference to grief for a lost one or to unfulfilled romantic love.
The notion of "Cupid's arrows" is ancient, due to Ovid, but while Ovid describes Cupid as wounding his victims with his arrows, it is not made explicit that it is the heart that is wounded. The familiar iconography of Cupid shooting little heart symbols is a Renaissance theme that became tied to Valentine's day.[93]
Food
Animal hearts are widely consumed as food. As they are almost entirely muscle, they are high in protein. They are often included in dishes with other offal, for example in the pan-Ottoman kokoretsi.
Chicken hearts are considered to be giblets, and are often grilled on skewers: Japanese hāto yakitoriBrazilian churrasco de coraçãoIndonesian chicken heart satay.[109] They can also be pan-fried, as in Jerusalem mixed grill. In Egyptian cuisine, they can be used, finely chopped, as part of stuffing for chicken.[110] Many recipes combined them with other giblets, such as the Mexican pollo en menudencias[111] and the Russian ragu iz kurinyikh potrokhov.[112]
The hearts of beef, pork, and mutton can generally be interchanged in recipes. As heart is a hard-working muscle, it makes for "firm and rather dry" meat,[113] so is generally slow-cooked. Another way of dealing with toughness is to julienne the meat, as in Chinese stir-fried heart.[114]
Beef heart may be grilled or braised.[115] In the Peruvian anticuchos de corazónbarbecued beef hearts are grilled after being tenderized through long marination in a spice and vinegar mixture. An Australian recipe for "mock goose" is actually braised stuffed beef heart.[116]
Pig heart is stewed, poached, braised,[117] or made into sausage. The Balinese oret is a sort of blood sausage made with pig heart and blood. A French recipe for cœur de porc à l'orange is made of braised heart with an orange sauce.
Other animals
Other vertebrates
The size of the heart varies among the different animal groups, with hearts in vertebrates ranging from those of the smallest mice (12 mg) to the blue whale (600 kg).[118] In vertebrates, the heart lies in the middle of the ventral part of the body, surrounded by a pericardium.[119] which in some fish may be connected to the peritoneum.[120]
The SA node is found in all amniotes but not in more primitive vertebrates. In these animals, the muscles of the heart are relatively continuous, and the sinus venosus coordinates the beat, which passes in a wave through the remaining chambers. Indeed, since the sinus venosus is incorporated into the right atrium in amniotes, it is likely homologous with the SA node. In teleosts, with their vestigial sinus venosus, the main centre of coordination is, instead, in the atrium. The rate of heartbeat varies enormously between different species, ranging from around 20 beats per minute in codfish to around 600 in hummingbirds[121] and up to 1200 bpm in the ruby-throated hummingbird.[122]
Double circulatory systems

- Pulmonary vein
- Left atrium
- Right atrium
- Ventricle
- Conus arteriosus
- Sinus venosus
Adult amphibians and most reptiles have a double circulatory system, meaning a circulatory system divided into arterial and venous parts. However, the heart itself is not completely separated into two sides. Instead, it is separated into three chambers—two atria and one ventricle. Blood returning from both the systemic circulation and the lungs is returned, and blood is pumped simultaneously into the systemic circulation and the lungs. The double system allows blood to circulate to and from lungs which deliver oxygenated blood directly to the heart.[123]
In reptiles, the heart is usually situated around the middle of the thorax, and in snakes, usually between the junction of the upper first and second third. There is a heart with three chambers: two atria and one ventricle. The ventricle is incompletely separated into two halves by a wall (septum), with a considerable gap near the pulmonary artery and aortic openings. In most reptilian species, there appears to be little, if any, mixing between the bloodstreams, so the aorta receives, essentially, only oxygenated blood.[121][123] The exception to this rule is crocodiles, which have a four-chambered heart.[124]
In the heart of lungfish, the septum extends part-way into the ventricle. This allows for some degree of separation between the de-oxygenated bloodstream destined for the lungs and the oxygenated stream that is delivered to the rest of the body. The absence of such a division in living amphibian species may be partly due to the amount of respiration that occurs through the skin; thus, the blood returned to the heart through the venae cavae is already partially oxygenated. As a result, there may be less need for a finer division between the two bloodstreams than in lungfish or other tetrapods. Nonetheless, in at least some species of amphibian, the spongy nature of the ventricle does seem to maintain more of a separation between the bloodstreams. Also, the original valves of the conus arteriosus have been replaced by a spiral valve that divides it into two parallel parts, thereby helping to keep the two bloodstreams separate.[121]
The fully divided heart
Archosaurs (crocodilians and birds) and mammals show complete separation of the heart into two pumps for a total of four heart chambers; it is thought that the four-chambered heart of archosaurs evolved independently from that of mammals. In crocodilians, there is a small opening, the foramen of Panizza, at the base of the arterial trunks and there is some degree of mixing between the blood in each side of the heart, during a dive underwater;[125][126] thus, only in birds and mammals are the two streams of blood—those to the pulmonary and systemic circulations—permanently kept entirely separate by a physical barrier.[121]
Fish

Blood flow through the fish heart: sinus venosus, atrium, ventricle, and outflow tract
Fish have what is often described as a two-chambered heart,[127] consisting of one atrium to receive blood and one ventricle to pump it.[128] However, the fish heart has entry and exit compartments that may be called chambers, so it is also sometimes described as three-chambered[128] or four-chambered,[129] depending on what is counted as a chamber. The atrium and ventricle are sometimes considered "true chambers", while the others are considered "accessory chambers".[130]
Primitive fish have a four-chambered heart, but the chambers are arranged sequentially so that this primitive heart is quite unlike the four-chambered hearts of mammals and birds. The first chamber is the sinus venosus, which collects deoxygenated blood from the body through the hepatic and cardinal veins. From here, blood flows into the atrium and then to the powerful muscular ventricle where the main pumping action will take place. The fourth and final chamber is the conus arteriosus, which contains several valves and sends blood to the ventral aorta. The ventral aorta delivers blood to the gills where it is oxygenated and flows, through the dorsal aorta, into the rest of the body. (In tetrapods, the ventral aorta has divided in two; one half forms the ascending aorta, while the other forms the pulmonary artery).[121]
In the adult fish, the four chambers are not arranged in a straight row but instead form an S-shape, with the latter two chambers lying above the former two. This relatively simpler pattern is found in cartilaginous fish and in the ray-finned fish. In teleosts, the conus arteriosus is very small and can more accurately be described as part of the aorta rather than of the heart proper. The conus arteriosus is not present in any amniotes, presumably having been absorbed into the ventricles over the course of evolution. Similarly, while the sinus venosus is present as a vestigial structure in some reptiles and birds, it is otherwise absorbed into the right atrium and is no longer distinguishable.[121]
Invertebrates

Arthropods and most mollusks have an open circulatory system. In this system, deoxygenated blood collects around the heart in cavities (sinuses). This blood slowly permeates the heart through many small one-way channels. The heart then pumps the blood into the hemocoel, a cavity between the organs. The heart in arthropods is typically a muscular tube that runs the length of the body, under the back and from the base of the head. Instead of blood the circulatory fluid is haemolymph which carries the most commonly used respiratory pigment, copper-based haemocyanin as the oxygen transporter; iron-based haemoglobin is used by only a few arthropods.[131]
In some other invertebrates such as earthworms, the circulatory system is not used to transport oxygen and so is much reduced, having no veins or arteries and consisting of two connected tubes. Oxygen travels by diffusion and there are five small muscular vessels that connect these vessels that contract at the front of the animals that can be thought of as "hearts".[131]
Squids and other cephalopods have two "gill hearts" also known as branchial hearts, and one "systemic heart". The brachial hearts have two atria and one ventricle each, and pump to the gills, whereas the systemic heart pumps to the body.[132][133]
Additional images
The human heart viewed from the front
The human heart viewed from behind
The human heart viewed from the front and from behind
Frontal section of the human heart
An anatomical specimen of the heart
Heart illustration with circulatory system
Notes
- ^ From the heart to the body
- ^ Arteries that contain deoxygenated blood, from the heart to the lungs
- ^ Supplying blood to the heart itself
- ^ From the body to the heart
- ^ Veins containing oxygenated blood from the lungs to the heart
- ^ Veins that drain blood from the cardiac tissue itself
- ^ Note the muscles do not cause the valves to open. The pressure difference between the blood in the atria and the ventricles does this.
- ^ Depolarisation of the ventricles occurs concurrently, but is not significant enough to be detected on an ECG.
References
This article incorporates text from the CC-BY book: OpenStax College, Anatomy & Physiology. OpenStax CNX. 30 jul 2014..
- ^ Taber, Clarence Wilbur; Venes, Donald (2009). Taber's cyclopedic medical dictionary. F. A. Davis Co. pp. 1018–1023. ISBN 978-0-8036-1559-5.
- ^ a b c Moore, Keith L.; Dalley, Arthur F .; Agur, Anne M. R. (2009). "1". Clinically Oriented Anatomy. Wolters Kluwel Health/Lippincott Williams & Wilkins. pp. 127–173. ISBN 978-1-60547-652-0.
- ^ Starr, Cecie; Evers, Christine; Starr, Lisa (2009). Biology: Today and Tomorrow With Physiology. Lernen lernen. p. 422. ISBN 978-0-495-56157-6. Archived from the original on 2 May 2016.
- ^ a b Reed, C. Roebuck; Brainerd, Lee Wherry; Lee,, Rodney; Inc, the staff of Kaplan, (2008). CSET : California Subject Examinations for Teachers (3rd ed.). New York: Kaplan Pub. p. 154. ISBN 978-1-4195-5281-6. Archived from the original on 4 May 2016.
- ^ a b c d e f g h i j k l m n o p q r s t u v w[1 9459007] x y z aa ab ac ad ae af ag ah ai aj ak al am an ao ap aq ar as at au av aw ax ay az ba bb bc bd be bf bg bh bi bj bk bl bm bn bo Betts, J. Gordon (2013). Anatomy & physiology. pp. 787–846. ISBN 978-1-938168-13-0. Retrieved 11 August 2014.
- ^ a b c "Cardiovascular diseases (CVDs) Fact sheet N°317 March 2013". WHO. World Health Organization. Archived from the original on 19 September 2014. Retrieved 20 September 2014.
- ^ a b c Longo, Dan; Fauci, Anthony; Kasper, Dennis; Hauser, Stephen; Jameson, J.; Loscalzo, Joseph (2011). Harrison's Principles of Internal Medicine (18 ed.). McGraw-Hill Professional. p. 1811. ISBN 978-0-07-174889-6.
- ^ Graham, I; Atar, D; Borch-Johnsen, K; Boysen, G; Burell, G; Cifkova, R; Dallongeville, J; De Backer, G; Ebrahim, S; Gjelsvik, B; Herrmann-Lingen, C; Hoes, A; Humphries, S; Knapton, M; Perk, J; Priori, SG; Pyorala, K; Reiner, Z; Ruilope, L; Sans-Menendez, S; Scholte op Reimer, W; Weissberg, P; Wood, D; Yarnell, J; Zamorano, JL; Walma, E; Fitzgerald, T; Cooney, MT; Dudina, A; European Society of Cardiology (ESC) Committee for Practice Guidelines, (CPG) (Oct 2007). "European guidelines on cardiovascular disease prevention in clinical practice: executive summary: Fourth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (Constituted by representatives of nine societies and by invited experts)". European Heart Journal. 28 (19): 2375–2414. doi:10.1093/eurheartj/ehm316. PMID 17726041.
- ^ "Gray's Anatomy of the Human Body – 6. Surface Markings of the Thorax". Bartleby.com. Archived from the original on 20 November 2010. Retrieved 18 October 2010.
- ^ Dorland's (2012). Dorland's Illustrated Medical Dictionary (32nd ed.). Elsevier p. 1461. ISBN 978-1-4160-6257-8.
- ^ Bianco, Carl. "How Your Heart Works". HowStuffWorks. Archived from the original on 29 July 2016. Retrieved 14 August 2016.
- ^ Ampanozi, Garyfalia; Krinke, Eileen; Laberke, Patrick; Schweitzer, Wolf; Thali, Michael J.; Ebert, Lars C. (7 May 2018). "Comparing fist size to heart size is not a viable technique to assess cardiomegaly". Cardiovascular Pathology: The Official Journal of the Society for Cardiovascular Pathology. 36: 1–5. doi:10.1016/j.carpath.2018.04.009. ISSN 1879-1336. PMID 29859507.
- ^ Pocock, Gillian (2006). Human Physiology. Oxford University Press. p. 264. ISBN 978-0-19-856878-0.
- ^ University of Minnesota. "Papillary Muscles". Atlas of Human Cardiac Anatomy. Archived from the original on 17 March 2016. Retrieved 7 March 2016.
- ^ "pectinate muscle". The Free Dictionary. Retrieved 2016-07-31.
- ^ "The human proteome in heart – The Human Protein Atlas". www.proteinatlas.org. Retrieved 2017-09-29.
- ^ Uhlén, Mathias; Fagerberg, Linn; Hallström, Björn M.; Lindskog, Cecilia; Oksvold, Per; Mardinoglu, Adil; Sivertsson, Åsa; Kampf, Caroline; Sjöstedt, Evelina (2015-01-23). "Tissue-based map of the human proteome". Wissenschaft . 347 (6220): 1260419. doi:10.1126/science.1260419. ISSN 0036-8075. PMID 25613900.
- ^ Lindskog, Cecilia; Linné, Jerker; Fagerberg, Linn; Hallström, Björn M.; Sundberg, Carl Johan; Lindholm, Malene; Huss, Mikael; Kampf, Caroline; Choi, Howard (2015-06-25). "The human cardiac and skeletal muscle proteomes defined by transcriptomics and antibody-based profiling". BMC Genomics. 16: 475. doi:10.1186/s12864-015-1686-y. ISSN 1471-2164. PMC 4479346. PMID 26109061.
- ^ J., Tortora, Gerard (2009). Principles of human anatomy. Nielsen, Mark T. (Mark Thomas) (11th ed.). Hoboken, NJ: J. Wiley. ISBN 978-0-471-78931-4. OCLC 213300667.
- ^ "Main Frame Heart Development". Meddean.luc.edu. Archived from the original on 16 November 2001. Retrieved 17 October 2010.
- ^ DuBose, T. J.; Cunyus, J. A.; Johnson, L. (1990). "Embryonic Heart Rate and Age". J Diagn Med Sonography. 6 (3): 151–157. doi:10.1177/875647939000600306.
- ^ DuBose, TJ (1996) Fetal Sonographypp. 263–274; Philadelphia: WB Saunders ISBN 0-7216-5432-0
- ^ DuBose, Terry J. (2011-07-26) Sex, Heart Rate and Age Archived 2 May 2014 at the Wayback Machine. obgyn.net
- ^ a b Berry, William; McKenzie, Catherine (1 January 2010). "Use of inotropes in critical care". Clinical Pharmacist. 2: 395. Archived from the original on 28 November 2016.
- ^ a b Bersten, Andrew (2013). Oh's Intensive Care Manual (7. ed.). London: Elsevier Health Sciences. pp. 912–922. ISBN 978-0-7020-4762-6.
- ^ Pocock, Gillian (2006). Human Physiology (Third ed.). Oxford University Press. p. 266. ISBN 978-0-19-856878-0.
- ^ Antz, Matthias; et al. (1998). "Electrical Conduction Between the Right Atrium and the Left Atrium via the Musculature of the Coronary Sinus". Auflage . 98 (17): 1790–1795. doi:10.1161/01.CIR.98.17.1790. PMID 9788835.
- ^ De Ponti, Roberto; et al. (2002). "Electroanatomic Analysis of Sinus Impulse Propagation in Normal Human Atria". Journal of Cardiovascular Electrophysiology. 13 (1): 1–10. doi:10.1046/j.1540-8167.2002.00001.x. PMID 11843475.
- ^ "Definition of SA node". MedicineNet.com. 27 April 2011. Archived from the original on 1 August 2012. Retrieved 7 June 2012.
- ^ "Purkinje Fibers". Über.com. 9 April 2012. Archived from the original on 14 April 2012. Retrieved 7 June 2012.
- ^ Davis, J. P.; Tikunova, S. B. (2008). "Ca2+ exchange with troponin C and cardiac muscle dynamics". Cardiovascular Research. 77 (4): 619–626. doi:10.1093/cvr/cvm098. PMID 18079104.
- ^ Ostchega, Y; Porter, K. S.; Hughes, J; Dillon, C. F.; Nwankwo, T (2011). "Resting pulse rate reference data for children, adolescents and adults, United States 1999–2008" (PDF). National Health Statistics Reports (41): 1–16. PMID 21905522. Archived (PDF) from the original on 23 June 2017.
- ^ Hall, Arthur C. Guyton, John E. (2005). Textbook of medical physiology (11th ed.). Philadelphia: W.B. Saunders pp. 116–122. ISBN 978-0-7216-0240-0.
- ^ a b c "Cardiovascular diseases (CVDs)". World Health Organization. Archived from the original on 10 March 2016. Retrieved 9 March 2016.
- ^ "Your Heart Failure Healthcare Team". www.heart.org. Archived from the original on 10 March 2016. Retrieved 9 March 2016.
- ^ a b "Different heart diseases". World Heart Federation. Archived from the original on 12 March 2016. Retrieved 9 March 2016.
- ^ a b c d e Ponikowski, Piotr; Voors, Adriaan A.; Anker, Stefan D.; Bueno, Héctor; Cleland, John G. F.; Coats, Andrew J. S.; Falk, Volkmar; González-Juanatey, José Ramón; Harjola, Veli-Pekka (August 2016). "2016 ESC Guidelines for the diagnosis and treatment of acute and chronic heart failure: The Task Force for the diagnosis and treatment of acute and chronic heart failure of the European Society of Cardiology (ESC). Developed with the special contribution of the Heart Failure Association (HFA) of the ESC". European Journal of Heart Failure. 18 (8): 891–975. doi:10.1002/ejhf.592. ISSN 1879-0844. PMID 27207191.
- ^ a b Vahanian, Alec; Alfieri, Ottavio; Andreotti, Felicita; Antunes, Manuel J.; Barón-Esquivias, Gonzalo; Baumgartner, Helmut; Borger, Michael Andrew; Carrel, Thierry P.; De Bonis, Michele (October 2012). "Guidelines on the management of valvular heart disease (version 2012): the Joint Task Force on the Management of Valvular Heart Disease of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS)". European Journal of Cardio-Thoracic Surgery: Official Journal of the European Association for Cardio-Thoracic Surgery. 42 (4): S1–44. doi:10.1093/ejcts/ezs455. ISSN 1873-734X. PMID 22922698.
- ^ a b Kirchhof, Paulus; Benussi, Stefano; Kotecha, Dipak; Ahlsson, Anders; Atar, Dan; Casadei, Barbara; Castella, Manuel; Diener, Hans-Christoph; Heidbuchel, Hein (November 2016). "2016 ESC Guidelines for the management of atrial fibrillation developed in collaboration with EACTS". Europace: European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 18 (11): 1609–1678. doi:10.1093/europace/euw295. ISSN 1532-2092. PMID 27567465.
- ^ a b c European Society of Cardiology (ESC); European Heart Rhythm Association (EHRA); Brignole, Michele; Auricchio, Angelo; Baron-Esquivias, Gonzalo; Bordachar, Pierre; Boriani, Giuseppe; Breithardt, Ole-A.; Cleland, John (August 2013). "2013 ESC guidelines on cardiac pacing and cardiac resynchronization therapy: the task force on cardiac pacing and resynchronization therapy of the European Society of Cardiology (ESC). Developed in collaboration with the European Heart Rhythm Association (EHRA)". Europace: European Pacing, Arrhythmias, and Cardiac Electrophysiology: Journal of the Working Groups on Cardiac Pacing, Arrhythmias, and Cardiac Cellular Electrophysiology of the European Society of Cardiology. 15 (8): 1070–1118. doi:10.1093/europace/eut206. ISSN 1532-2092. PMID 23801827.
- ^ Blomström-Lundqvist, Carina; Scheinman, Melvin M.; Aliot, Etienne M.; Alpert, Joseph S.; Calkins, Hugh; Camm, A. John; Campbell, W. Barton; Haines, David E.; Kuck, Karl H. (2003-10-14). "ACC/AHA/ESC guidelines for the management of patients with supraventricular arrhythmias – executive summary: a report of the American College of Cardiology/American Heart Association Task Force on Practice Guidelines and the European Society of Cardiology Committee for Practice Guidelines (Writing Committee to Develop Guidelines for the Management of Patients With Supraventricular Arrhythmias)". Auflage . 108 (15): 1871–1909. doi:10.1161/01.CIR.0000091380.04100.84. ISSN 1524-4539. PMID 14557344.
- ^ Baumgartner, Helmut; Bonhoeffer, Philipp; De Groot, Natasja M. S.; de Haan, Fokko; Deanfield, John Erik; Galie, Nazzareno; Gatzoulis, Michael A.; Gohlke-Baerwolf, Christa; Kaemmerer, Harald (December 2010). "ESC Guidelines for the management of grown-up congenital heart disease (new version 2010)". European Heart Journal. 31 (23): 2915–2957. doi:10.1093/eurheartj/ehq249. ISSN 1522-9645. PMID 20801927.
- ^ Britton, the editors Nicki R. Colledge, Brian R. Walker, Stuart H. Ralston; illustrated by Robert (2010). Davidson's principles and practice of medicine (21st ed.). Edinburgh: Churchill Livingstone/Elsevier. pp. 522–536. ISBN 978-0-7020-3084-0.
- ^ a b Talley, Nicholas J.; O'Connor, Simon. Clinical Examination. Churchill Livingstone. pp. 76–82. ISBN 978-0-7295-4198-5.
- ^ Coven, David; Yang, Eric. "Acute Coronary Syndrome Workup". Medscape. Archived from the original on 6 August 2016. Retrieved 14 August 2016.
- ^ Armstrong, William F.; Ryan, Thomas; Feigenbaum, Harvey (2010). Feigenbaum's Echocardiography. Lippincott Williams & Wilkins. ISBN 978-0-7817-9557-9. Archived from the original on 23 April 2016.
- ^ Authors/Task Force Members:; Piepoli, Massimo F.; Hoes, Arno W.; Agewall, Stefan; Albus, Christian; Brotons, Carlos; Catapano, Alberico L.; Cooney, Marie-Therese; Corrà, Ugo (September 2016). "2016 European Guidelines on cardiovascular disease prevention in clinical practice: The Sixth Joint Task Force of the European Society of Cardiology and Other Societies on Cardiovascular Disease Prevention in Clinical Practice (constituted by representatives of 10 societies and by invited experts) Developed with the special contribution of the European Association for Cardiovascular Prevention & Rehabilitation (EACPR)". Atherosclerosis. 252: 207–274. doi:10.1016/j.atherosclerosis.2016.05.037. ISSN 1879-1484. PMID 27664503.
- ^ a b Kolh, Philippe; Windecker, Stephan; Alfonso, Fernando; Collet, Jean-Philippe; Cremer, Jochen; Falk, Volkmar; Filippatos, Gerasimos; Hamm, Christian; Head, Stuart J. (October 2014). "2014 ESC/EACTS Guidelines on myocardial revascularization: the Task Force on Myocardial Revascularization of the European Society of Cardiology (ESC) and the European Association for Cardio-Thoracic Surgery (EACTS). Developed with the special contribution of the European Association of Percutaneous Cardiovascular Interventions (EAPCI)". European Journal of Cardio-Thoracic Surgery: Official Journal of the European Association for Cardio-Thoracic Surgery. 46 (4): 517–592. doi:10.1093/ejcts/ezu366. ISSN 1873-734X. PMID 25173601.
- ^ a b c "Anatomy of the Heart". University of Sydney Online Museum. Archived from the original on 18 August 2016. Retrieved 2 August 2016.
- ^ a b c d Meletis, John; Konstantopoulos, Kostas (2010). "The Beliefs, Myths, and Reality Surrounding the Word Hema (Blood) from Homer to the Present". Anemia. 2010: 1–6. doi:10.1155/2010/857657. PMC 3065807. PMID 21490910.
- ^ Katz, A. M. (1 May 2008). "The "Modern" View of Heart Failure: How Did We Get Here?". Circulation: Heart Failure. 1 (1): 63–71. doi:10.1161/CIRCHEARTFAILURE.108.772756. PMID 19808272.
- ^ a b c d e f g Aird, W. C. (July 2011). "Discovery of the cardiovascular system: from Galen to William Harvey". Journal of Thrombosis and Hämostasis . 9: 118–29. doi:10.1111/j.1538-7836.2011.04312.x. PMID 21781247.
- ^ Michelakis, E. D. (19 June 2014). "Pulmonary Arterial Hypertension: Yesterday, Today, Tomorrow". Circulation Research. 115 (1): 109–114. doi:10.1161/CIRCRESAHA.115.301132. PMID 24951761.
- ^ West, John (2008). "Ibn al-Nafis, the pulmonary circulation, and the Islamic Golden Age". Journal of Applied Physiology. 105 (6): 1877–1880. doi:10.1152/japplphysiol.91171.2008. PMC 2612469. PMID 18845773.
- ^ Bondke Persson, A.; Persson, P. B. (2014). "Form and function in the vascular system". Acta Physiologica. 211 (3): 468–470. doi:10.1111/apha.12309. PMID 24800879.
- ^ a b West, J. B. (30 May 2014). "Galen and the beginnings of Western physiology". AJP: Lung Cellular and Molecular Physiology. 307 (2): L121–L128. doi:10.1152/ajplung.00123.2014. PMID 24879053.
- ^ Silverman, M. E. (13 June 2006). "Why Does the Heart Beat?: The Discovery of the Electrical System of the Heart". Auflage . 113 (23): 2775–2781. doi:10.1161/CIRCULATIONAHA.106.616771. PMID 16769927.
- ^ Cooley, Denton A. (2011). "Recollections of the Early Years of Heart Transplantation and the Total Artificial Heart". Artificial Organs. 35 (4): 353–357. doi:10.1111/j.1525-1594.2011.01235.x. PMID 21501184.
- ^ Miniati, Douglas N.; Robbins, Robert C. (2002). "Heart transplantation: a thirty-year perspective: A Thirty-Year Perspective". Annual Review of Medicine. 53 (1): 189–205. doi:10.1146/annurev.med.53.082901.104050. PMID 11818470.
- ^ Neubauer, Stefan (15 March 2007). "The Failing Heart – An Engine Out of Fuel". New England Journal of Medicine. 356 (11): 1140–1151. doi:10.1056/NEJMra063052. PMID 17360992.
- ^ a b c Tresidder, Jack (2012). "Heart". The Watkins Dictionary of Symbols. ISBN 978-1-78028-357-9.
- ^ Rosner, Fred (1995). Medicine in the Bible and the Talmud : selections from classical Jewish sources (Augm. ed.). Hoboken, NJ: KTAV Pub. House. pp. 87–96. ISBN 978-0-88125-506-5.
- ^ BritannicaIb Archived 7 January 2009 at the Wayback Machine; SliderAb, Egyptian heart and soul conception[permanent dead link]. The word was also transcribed by Wallis Budge as Ab.
- ^ Allen, James P. (2014). Middle Egyptian : an introduction to the language and culture of hieroglyphs (3rd ed.). pp. 453, 465. ISBN 978-1-107-66328-2.
- ^ Taylor, John H. (2001). Death and the afterlife in ancient Egypt. Chicago: Die Universität von Chicago Press. pp. 35–38. ISBN 978-0-226-79164-7.
- ^ Xigui, Qiu; Mattos, Gilbert L (2000). Chinese writing = Wenzi-xue-gaiyao. Berkeley: Society for the Study of Early China [u.a.] p. 176. ISBN 978-1-55729-071-7.
- ^ MDBG online dictionary. "心" Archived 4 October 2016 at the Wayback Machine.
- ^ Rogers, Flaws, Bob (2007). Statements of fact in traditional Chinese medicine (3rd ed.). Boulder, Colo.: Blue Poppy Press. p. 47. ISBN 978-0-936185-52-1.
- ^ Wiseman, Nigel and Ye, Feng (1998). A practical dictionary of Chinese medicine (1st ed.). Brookline, Mass.: Paradigm Publications. p. 260. ISBN 978-0-912111-54-4.CS1 maint: Multiple names: authors list (link)
- ^ Sellmer, Sven (2004), "The Heart in the Ŗg veda", in Piotr Balcerowicz; Marek Mejor, Essays in Indian Philosophy, Religion and LiteratureDelhi: Motilal Banarsidass Publishers, pp. 71–83, ISBN 978-81-208-1978-8, archived from the original on 6 December 2016
- ^ Lanman, Charles Rockwell (1996). A Sanskrit reader : text and vocabulary and notes (repr ed.). Delhi: Motilal Banarsidass. p. 287. ISBN 978-81-208-1363-2.
- ^ Aristotle. On the Parts of Animals. book 3, ch. 4. Archived from the original on 14 August 2016(De partibus animalium)
- ^ Galen, De usu partium corporis humani ("The Use of the Parts of the Human Body"), book 6.
- ^ Sandstrom, Alan (1991) Corn is Our Blood. Universität von Oklahoma Press. pp. 239–240. ISBN 0-8061-2403-2.
- ^ Kurian G (2001). "Sacred Heart of Jesus". Nelson's Dictionary of Christianity: The Authoritative Resource on the Christian World. Thomas Nelson Inc. ISBN 978-1-4185-3981-8.
- ^ Murray, Tom Devonshire Jones; Linda Murray; Peter (2013). "Heart". The Oxford dictionary of christian art and architecture (Second ed.). Corby: Oxford University Press. ISBN 978-0-19-968027-6.
- ^ Indonesia Magazine25 (1994), p. 67
- ^ Abdennour, Samia (2010) "Firakh mahshiya wi mihammara", recipe 117, Egyptian Cooking: And Other Middle Eastern RecipesAmerican University in Cairo Press. ISBN 977-424-926-7.
- ^ Kennedy, Diana (2013) My Mexico: A Culinary Odyssey with RecipesUniversity of Texas Press. p. 100. ISBN 0-292-74840-X.
- ^ Sacharow, Alla (1993) Classic Russian Cuisine: A Magnificent Selection of More Than 400 Traditional Recipes. ISBN 1-55970-174-9
- ^ Rombauer, Irma S.; Becker, Marion Rombauer; Becker, Ethan (1975). The Joy of Cooking. The Bobbs-Merrill Company. p. 508. ISBN 978-0-02-604570-4.
- ^ Schwabe, Calvin W. (1979) Unmentionable CuisineUniversity of Virginia Press, ISBN 0-8139-1162-1, p. 96
- ^ Rombauer, Irma S. and Rombauer Becker, Marion (1975) The Joy of Cookingp. 508
- ^ Torode, John (2009) Beef: And Other Bovine MattersTaunton Press, ISBN 1-60085-126-6, p. 230
- ^ Milsom, Jennie (2009) The Connoisseur's Guide to Meat. Sterling Publishing Company. p. 171. ISBN 1-4027-7050-2
- ^ Dobson, Geoffrey P (August 2003). "On Being the Right Size: Heart Design, Mitochondrial Efficiency and Lifespan Potential". Clinical and Experimental Pharmacology and Physiology. 30 (8): 590–597. doi:10.1046/j.1440-1681.2003.03876.x.
- ^ Hyman, L. Henrietta (1992). Hyman's Comparative Vertebrate Anatomy. Universität von Chicago Press. pp. 448–. ISBN 978-0-226-87013-7. Archived from the original on 6 December 2016.
- ^ Shuttleworth, Trevor J., ed. (1988). Physiology of Elasmobranch Fishes. Berlin, Heidelberg: Springer Berlin Heidelberg. p. 3. ISBN 978-3-642-73336-9.
- ^ a b c d e f Romer, Alfred Sherwood; Parsons, Thomas S. (1977). The Vertebrate Body. Philadelphia: Holt-Saunders International. pp. 437–442. ISBN 978-0-03-910284-5.
- ^ Osborne, June (1998). The Ruby-Throated Hummingbird. Universität von Texas Press. p. 14. ISBN 978-0-292-76047-9.
- ^ a b Grimm, Kurt A.; Lamont, Leigh A.; Tranquilli, William J.; Greene, Stephen A.; Robertson, Sheilah A. (2015). Veterinary Anesthesia and Analgesia. John Wiley & Sons. p. 418. ISBN 978-1-118-52620-0. Archived from the original on 6 December 2016.
- ^ Colville, Thomas P.; Bassert, Joanna M. (2015). Clinical Anatomy and Physiology for Veterinary Technicians. Elsevier Health Sciences. p. 547. ISBN 978-0-323-35620-6. Archived from the original on 6 December 2016.
- ^ Crigg, Gordon; Johansen, Kjell (1987). "Cardiovascular Dynamics In Crocodylus Porosus Breathing Air And During Voluntary Aerobic Dives". Journal of Comparative Physiology B. 157 (3): 381–392. doi:10.1007/BF00693365.
- ^ Axelsson, Michael; Craig, Franklin; Löfman, Carl; Nilsson, Stefan; Crigg, Gordon (1996). "Dynamic Anatomical Study Of Cardiac Shunting In Crocodiles Using High-Resolution Angioscopy" (PDF). The Journal of Experimental Biology. 199 (2): 359–365. PMID 9317958. Archived (PDF) from the original on 3 March 2015. Retrieved 3 July 2012.
- ^ Jurd, Richard David (2004). Instant Notes Animal Biology. Garland Science. p. 134. ISBN 978-1-85996-325-8. Archived from the original on 6 December 2016.
- ^ a b Ostrander, Gary Kent (2000). The Laboratory Fish. Elsevier pp. 154–155. ISBN 978-0-12-529650-2. Archived from the original on 6 December 2016.
- ^ Farrell, Anthony P, ed. (2011). Encyclopedia of Fish Physiology: From Genome to Environment. Stevens, E Don; Cech, Jr., Joseph J; Richards, Jeffrey G. Academic Press. p. 2315. ISBN 978-0-08-092323-9. Archived from the original on 6 December 2016.
- ^ Shukla, J.P. Fish & Fisheries. Rastogi Publications. pp. 154–155. ISBN 978-81-7133-800-9. Archived from the original on 6 December 2016.
- ^ a b Solomon, Eldra; Berg, Linda; Martin, Diana W. (2010). Biology. Lernen lernen. p. 939. ISBN 978-1-133-17032-7. Archived from the original on 6 December 2016.
- ^ "Meet our animals". Smithsonian National Zoological Park. Archived from the original on 29 July 2016. Retrieved 14 August 2016.
- ^ Ladd, Prosser C (1991). Comparative Animal Physiology, Environmental and Metabolic Animal Physiology. John Wiley & Sons. pp. 537–. ISBN 978-0-471-85767-9. Archived from the original on 6 December 2016.
Bibliography
- Hall, John (2011). Guyton and Hall textbook of medical physiology (12th ed.). Philadelphia: Saunders / Elsevier. ISBN 978-1-4160-4574-8.
- Longo, Dan; Fauci, Anthony; Kasper, Dennis; Hauser, Stephen; Jameson, J.; Loscalzo, Joseph (2011). Harrison's Principles of Internal Medicine (18 ed.). McGraw-Hill Professional. ISBN 978-0-07-174889-6.
- Susan Standring; Neil R. Borley; et al., Hrsg. (2008). Gray's anatomy : the anatomical basis of clinical practice (40th ed.). London: Churchill Livingstone. ISBN 978-0-8089-2371-8.
- Nicki R. Colledge; Brian R. Walker; Stuart H. Ralston, eds. (2010). Davidson's principles and practice of medicine (21st ed.). Edinburgh: Churchill Livingstone/Elsevier. ISBN 978-0-7020-3085-7.







No comments:
Post a Comment